Wie SARS-CoV-2 unser Immunsystem beeinflusst
Dass COVID-19 eine tückische Krankheit ist, ist nach über drei Jahren Pandemie mit rund 20 Millionen Todesopfern allgemein bekannt. Das auslösende Virus, SARS-CoV-2, hielt die Welt sprichwörtlich lange Zeit in Atem. Es infiziert hauptsächlich die Lungenzellen und löst mannigfaltige Symptome mit oft ungewissen Krankheitsverläufen aus. Dank Impfung ist die Pandemie weitgehend beendet, doch bleiben immer noch offene Fragen, wie zum Beispiel, was das Virus eigentlich in unserem Körper anstellt und wie es auf unser Immunsystem wirkt? Forschende der Abteilung Primatengenetik sowie der Plattform Infektionsmodelle am DPZ sind diesen Fragen nachgegangen. Sie untersuchten an Kulturen menschlicher Lungenzellen wie eine SARS-CoV-2-Infektion die Immunreaktionen im Detail beeinflusst. Die Wissenschaftler*innen fanden heraus, dass ein bestimmtes Peptid im Spike-Protein des Virus die vermehrte Bildung eines Oberflächenproteins bewirkt, das ein wichtiger Faktor des angeborenen Immunsystems ist. Das Protein aktiviert seinerseits spezielle adaptive natürliche Killerzellen und löst in SARS-CoV-2-Patienten die Neubildung dieser Killerzellen aus, die bislang ausschließlich bei einer Infektion mit dem Zytomegalie-Herpesvirus (CMV) nachgewiesen werden konnten.
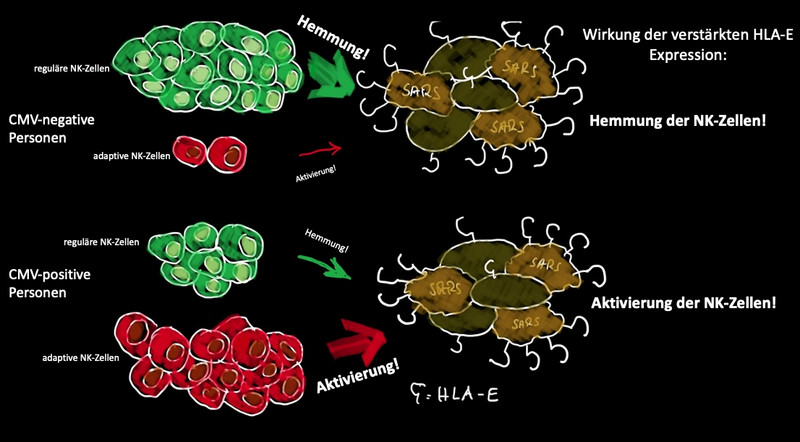
Infizieren wir uns mit einem unbekannten Erreger, ist unser Körper ihm nicht wehrlos ausgeliefert. Unser angeborenes Immunsystem löst Reaktionen aus, die infizierte Zellen effektiv abtöten können. Eine erste Verteidigungslinie im Kampf gegen Infektionen bilden beispielsweise die natürlichen Killerzellen (NK-Zellen). Sie können infizierte Zellen vernichten, ohne vorher mit dem Erreger in Kontakt gewesen zu sein. NK-Zellen erkennen unter anderem sogenannte MHC-Klasse-I-Proteine, die auf der Oberfläche von allen gesunden Körperzellen vorkommen. Unter diesen verschiedenen MHC-Klasse-I-Proteinen befindet sich auch das Protein HLA-E. NK-Zellen können HLA-E sowohl über einen inhibierenden Rezeptor (NKG2A) als auch über einen stimulierenden Rezeptor (NKG2C) binden und entsprechend gehemmt oder aktiviert werden. Normalerweise sind die mit dem inhibierenden NKG2A-Rezeptor ausgestatteten NK-Zellen zahlenmäßig stark vertreten, während die mit dem stimulierenden NKG2C-Rezeptor eher in der Unterzahl sind.
Allerdings gibt es Viren, die sich im Laufe der Evolution so verändert haben, dass sie diese erste Verteidigungsstrategie des Immunsystems umgehen können. Ein bekannter Vertreter ist das Zytomegalievirus (CMV), das zur Gruppe der Herpesviren gehört. Das Virus schafft es, dass das HLA-E-Protein nach Infektion nicht wie sonst herunterreguliert, sondern sogar verstärkt auf der Zelloberfläche produziert wird. Das Virus gaukelt sozusagen der Zelle vor, dass sie gar nicht infiziert ist. Dadurch werden die NK-Zellen mit dem inhibierenden NKG2A-Rezeptor weiter gehemmt und das Virus kann sich ungestört in den Zellen vermehren.
Eine weitere Besonderheit ist, dass eine CMV-Infektion beim Menschen häufig zur vermehrten Bildung von sogenannten adaptiven natürlichen Killerzellen führen kann. Sie besitzen den stimulierenden NKG2C-Rezeptor auf ihrer Zelloberfläche und können das verstärkte HLA-E auf den CMV-infizierten Zellen über NKG2C erkennen und diese Zellen abtöten. Adaptive natürliche Killerzellen haben gegenüber den regulären NK-Zellen den Vorteil, dass sie schneller reagieren, langlebiger sind und einen Gedächtniseffekt besitzen. Etwa ein Drittel aller CMV-positiven Menschen besitzt die adaptiven NK-Zellen in größerer Menge. So wird die latente Infektion in Schach gehalten, da Herpesviren ein Leben lang im Körper bleiben.
Die Forschenden am DPZ wollten nun herausfinden, welchen Einfluss eine SARS-CoV-2-Infektion auf die Bildung des HLA-E-Proteins hat, sozusagen als Schlüssel für die Funktion der NK-Zellen. Dafür infizierten sie zunächst menschliche Lungenzellen mit dem Virus und konnten nachweisen, dass das HLA-E-Protein ähnlich wie bei einer CMV-Infektion auf der Zelloberfläche vermehrt gebildet wird. Selbiges Ergebnis erhielten sie, nachdem sie die Zellen nur mit dem Spike-Protein des Virus behandelten.
Anschließend führten die Wissenschaftler*innen eine detaillierte Analyse des Spike-Proteins durch, um herauszufinden, welcher Teil davon die Bildung von HLA-E hervorruft. Durch in silico-Analysen identifizierten sie ein neun Aminosäuren langes Peptid als möglichen Kandidaten.
„Die Behandlung der Lungenzellen nur mit dem Peptid reichte aus, um die vermehrte Produktion von HLA-E auszulösen“, fasst Lutz Walter, Leiter der Abteilung Primatengenetik, die Ergebnisse zusammen. „Darüber hinaus konnten wir zeigen, dass der Austausch einer einzigen Aminosäure im Peptid, die Induktion von HLA-E unterbinden kann. Wir konnten also nicht nur nachweisen, dass SARS-CoV-2 die Bildung von HLA-E induziert, sondern konnten auch genau zeigen, welches Peptid im Spike-Protein dafür verantwortlich ist.“
Im Folgenden wollten die Wissenschaftler*innen wissen, welche Auswirkungen die vermehrte Bildung von HLA-E auf die Funktion der NK-Zellen hat. Um das zu überprüfen, behandelten sie erneut Lungenzellen mit dem Spike-Protein. „Hier spielte der CMV-Status eine entscheidende Rolle“, erklärt Lutz Walter. „In Zellen, die von CMV-negativen Personen stammten, konnten wir sehen, dass die Funktion der NK-Zellen inhibiert wurde, da diese Menschen mehr von den NK-Zellen mit inhibierendem NKG2A-Rezeptor besitzen. In NK-Zellen von CMV-positiven Personen konnten wir durch die Zugabe des Spike-Proteins hingegen eine eindeutige Stimulation der NK-Zellfunktionen beobachten, da diese durch die CMV-Infektion viel mehr von den adaptiven NK-Zellen mit stimulierendem NKG2C-Rezeptor enthalten.“ Die Immunreaktion der NK-Zellen auf eine SARS-CoV-2-Infektion hängt also auch davon ab, ob die infizierten Personen bereits mit dem Zytomegalievirus infiziert sind.
Auf Basis dieser Ergebnisse wollten die Forschenden herausfinden, ob eine SARS-CoV-2-Infektion auch die Neubildung adaptiver NK-Zellen mit stimulierendem Rezeptor bewirkt. Dafür untersuchten sie Blutproben von hospitalisierten COVID-19-Patienten mit positivem und negativem CMV-Status. Sie konnten zeigen, dass die SARS-CoV-2-Infektion die Bildung neuer adaptiver NK-Zellen in allen Patienten unabhängig von deren CMV-Status hervorrief. Eine anschließende Analyse von Blutproben genesener COVID-19-Patienten ergab allerdings, dass sich die Neubildung adaptiver NK-Zellen auf die akute Phase der Infektion beschränkt. In genesenen Patienten waren diese frühen adaptiven NK-Zellen nicht mehr nachzuweisen.
„Dass die Bildung adaptiver NK-Zellen auch durch ein anderes Virus außer CMV hervorgerufen werden kann, ist eine ganz neue Erkenntnis“, sagt Lutz Walter. „Dass diese Zellen nach Genesung wieder verschwinden, liegt wahrscheinlich daran, dass SARS-CoV-2 im Gegensatz zu CMV nicht im Körper verbleibt. Hier stellt sich jedoch die Frage, ob es diesbezüglich einen Unterschied bei Long-COVID-Patienten gibt. Möglicherweise verbleibt hier ein Virusreservoir im Körper, das eine ständige Stimulation adaptiver NK-Zellen hervorruft und damit auch die unterschiedlichen Langzeitsymptome. Ob das so ist, müssen weitere Studien zeigen.“
Die Studie wurde als Gemeinschaftsprojekt von Lutz Walter und Markus Uhrberg (Universitätsklinikum Düsseldorf) im Rahmen der Fokus-Förderung COVID-19 von der Deutschen Forschungsgemeinschaft (DFG) finanziert. Neben DPZ und dem Universitätsklinikum Düsseldorf waren Forschende des Fraunhofer-Instituts für Toxikologie und Experimentelle Medizin (ITEM) und der Medizinischen Hochschule Hannover sowie des Leibniz-Instituts für Arbeitsforschung (IfADo) an der Technischen Universität Dortmund beteiligt.
Originalpublikation
Hasan MZ, Claus M, Krüger N, Reusing S, Gall E, Bade-Döding C., Braun A, Watzl C, Uhrberg M & Walter, L. (2024): SARS-CoV-2 infection induces adaptive NK cell responses by spike protein-mediated induction of HLA-E expression. Emerging Microbes & Infections. DOI: 10.1080/22221751.2024.2361019